
FastClean Plant Genomic DNA Kit
植物基因组DNA快速提取试剂盒
¥398.00
CW0571S
- + [ 现货 ]
加入购物车
- 产品介绍
- 相关产品
- 产品参数
- 产品说明书
- FAQs

本产品采用特异性结合DNA的离心柱和独特的缓冲系统,能从多种植物中分离纯化得到高质量基因组DNA,操作简便,可在30 min内完成提取。独特的溶液可以有效沉淀去除植物样本中的蛋白质、多糖以及酚类等杂质,提取的基因组DNA得率高、纯度高、质量稳定可靠,适用于PCR、荧光定量PCR、分子标记、文库构建等下游实验。

▪ 兼容性强:支持多种植物样本,可从茎、叶、花、果实、种子等不同组织中提取高纯度基因组DNA。
▪ 安全无毒:采用先进的缓冲系统,无需酚/氯仿等有毒试剂,使DNA提取更加高效、安全。
▪ 性能优异:提取的基因组DNA纯度高、完整性好。
▪ 操作简单:30 min内即可获得高质量的基因组DNA。
1. 样本兼容性强
【实验一】使用康为世纪CW0571提取植物叶片、种子、果实等样本,提取产物进行琼脂糖凝胶电泳分析,结果如下图:
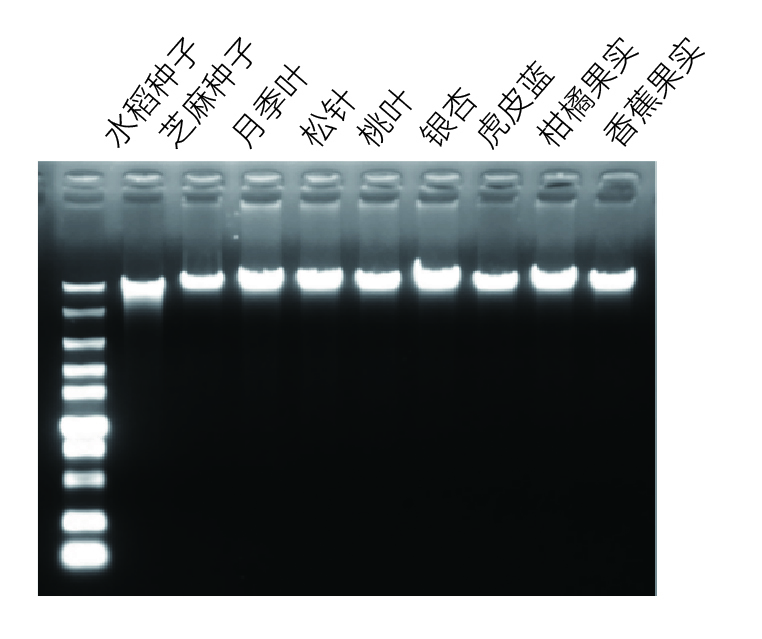
实验结果表明:康为世纪植物DNA提取试剂盒可兼容植物叶片、种子、果实等样本,尤其适用于多糖多酚样本,获得的DNA浓度高、质量好。


| 保存条件 | 运输条件 |
|---|---|
| RT(15-30℃) | 室温 |

此为正常现象。将 Buffer GSL 置于37℃水浴中溶解,摇匀后即可使用,不影响效果。
不是。对于简单植物样本,破碎后震荡混匀,室温放置10分钟即可,无需加热。复杂样本建议70℃加热孵育10分钟。
可在样本前处理步骤中加入 5% β-巯基乙醇,可有效提升得率。
若柱膜有明显的颜色残留可利用500 μL无水乙醇漂洗一次,再进行后续步骤。
正常。
若下游实验对pH值或EDTA敏感,可采用灭菌水作为洗脱液。使用前需调节水的pH值至7.0-8.5(可用NaOH调节),pH值低于7.0会显著降低洗脱效率。如需长期保存洗脱产物,推荐使用Buffer TB,并于-20℃保存。
需确保植物组织经液氮或组织破碎仪充分破碎,加入Buffer PSS后充分混匀,离心后小心吸取上清液避免吸入沉淀,对多糖多酚含量高的复杂样本应适当减少起始用量。
(1) 样本起始投入量不要超过所用方法的起始量标准;
(2) 样品保存时要尽可能的避免反复冻融;
(3) 样本应进行充分裂解:确保组织在液氮或组织破碎仪中充分破碎,并充分涡旋混合。
(4) Buffer CW1和Buffer GW2中无水乙醇添加量不准确或漏加:应按照试剂瓶标签正确添加无水乙醇。
(5) 确保无乙醇残留:空离后将吸附柱开盖室温静置数分钟,彻底挥发乙醇。(6) 洗脱不充分: DNA 产物洗脱的时候,预热洗脱液并滴加在膜中央位置,尽可能的覆盖整个吸附膜,增加洗脱体积或者二次洗脱也可增加产量。
1. A260/A280比值低(<1.7)。原因:蛋白或乙醇残留导致污染。解决方法:
1) 确保裂解充分:使用前请检查Buffer GSL是否出现结晶或者沉淀,如有结晶或者沉淀,于56℃水浴孵育至重新溶解。
2) 去除乙醇残留:吸附柱空离2分钟后将吸附柱开盖置于室温数分钟,以彻底晾干。
2. A260/A280比值高(>2.0)。原因:核酸降解。
解决方法:
1) 避免降解:使用新鲜样本,避免样本反复冻融。
2) 优化洗脱:若采用灭菌水作为洗脱液。使用前需调节水的pH值至7.0-8.5(可用NaOH调节)。








