
Magbead Tissue RNA Kit (DNase I)
磁珠法组织RNA提取试剂盒(DNase I)
¥998.00
CW3711S
- + [ 现货 ]
加入购物车
- 产品介绍
- 相关产品
- 产品参数
- 产品说明书
- FAQs

本试剂盒提供了一种简单、高效的动物组织RNA自动化提取方案。动物组织经物理方法破碎后,裂解产物中的RNA在高盐存在时结合于硅基包被的磁珠表面,经漂洗液漂洗去除蛋白质等杂质,然后加入DNase I去除DNA,最后RNA经过漂洗后洗脱于RNase-Free Water中。提取过程中无需使用β-巯基乙醇和酚/氯仿等有毒有害试剂,即可提取得到高质量的RNA。提取的RNA可用于RT-PCR、Real-Time PCR、芯片分析、体外翻译等多种下游实验。

▪ 安全无毒:无需使用酚氯仿、β-巯基乙醇和DTT等有毒试剂。
▪ 高效提取:完整性好,得率高,无DNA 残留。
▪ 兼容性广:可兼容各种动物组织样本。
▪ 高通量自动化:提取迅速,约35分钟即可完成96个样本的总RNA提取。

1.高浓度,高得率
【实验一】分别取20-30 mg小鼠肝脏、小鼠肺、小鼠皮肤、鸡心脏、小鼠尾巴,使用康为世纪和A公司的磁珠法动物RNA提取试剂盒进行总RNA提取,洗脱体积为70 μL,提取结果如下:
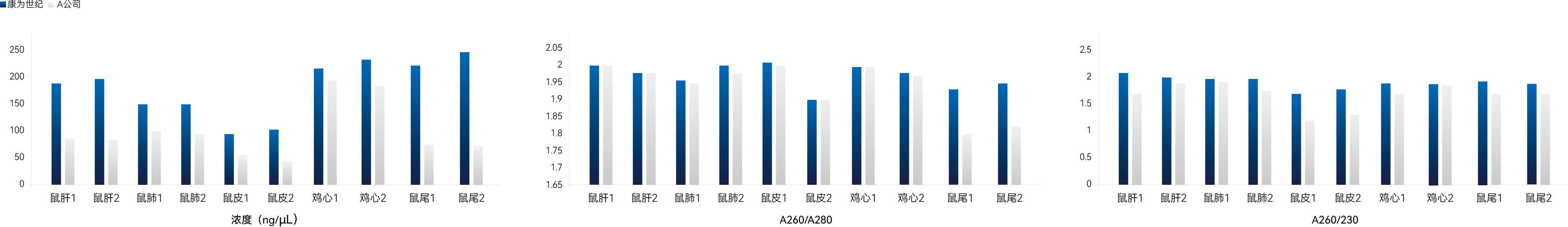
图1:动物组织总RNA提取结果(浓度、A260/A280、A260/A230)图
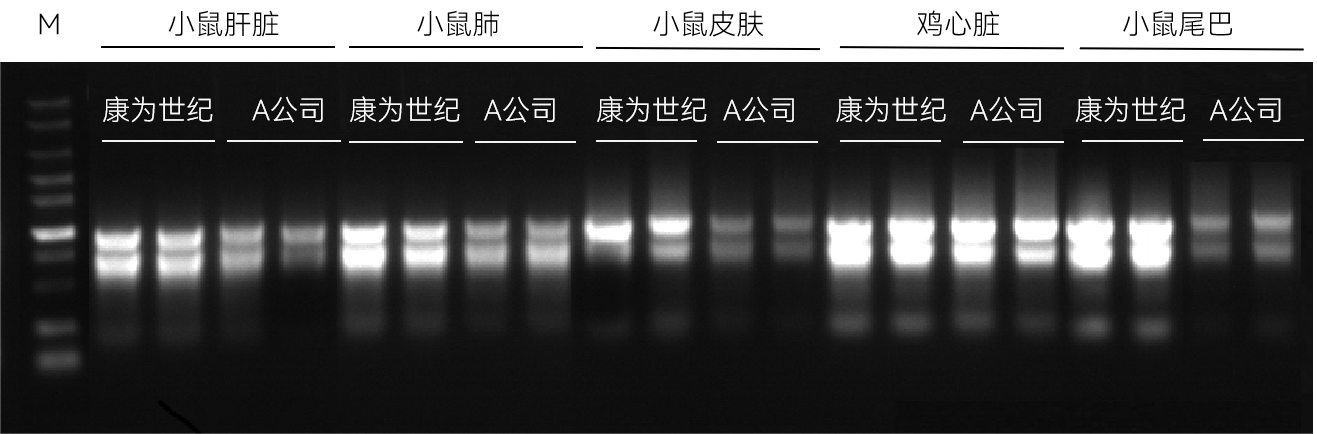
图2:动物组织总RNA提取琼脂糖凝胶电泳图
实验结果表明:康为世纪磁珠法动物RNA提取试剂盒能够高效的从动物组织中提取高质量RNA,提取结果优于A公司。获得的总RNA完整性好,得率高,无DNA 残留。
2. 高完整度
【实验二】提取完的RNA用QSEP100全自动核酸蛋白分析系统进行完整度检测,检测结果结果如下:
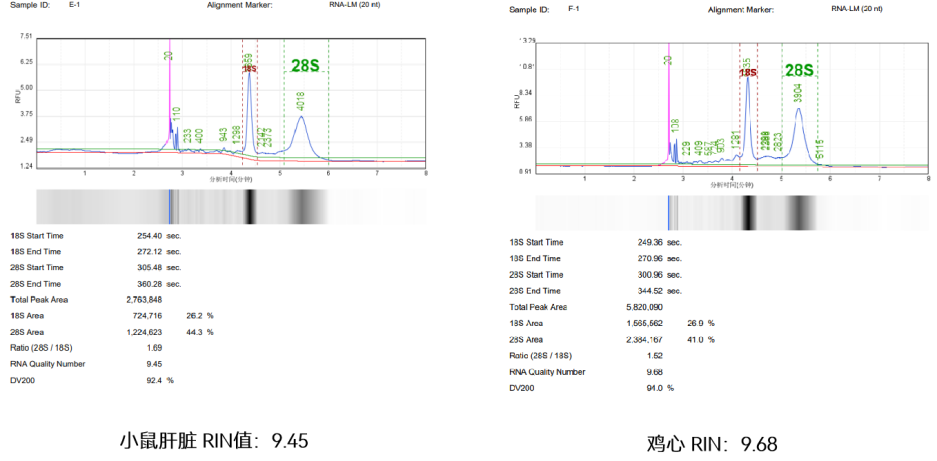
图3:康为世纪提取RNA RIN值检测
实验结果表明:康为世纪磁珠法动物RNA提取试剂盒提取的RNA RIN值大于9,具有较高的完整性。
3. 样本兼容性广
【实验三】分别取20-30 mg各类型的动物组织样本,使用康为世纪磁珠法动物RNA提取试剂盒,进行总RNA提取,70 μL洗脱。提取结果如下。
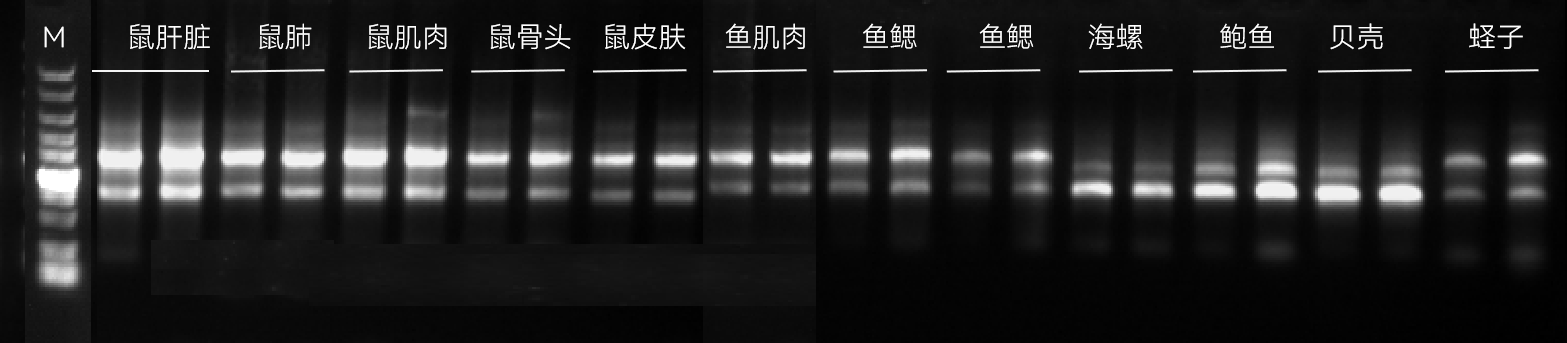
图4:各种植物样本总RNA提取琼脂糖凝胶电泳图
实验结果表明:康为世纪磁珠法动物RNA提取试剂盒可以兼容各种类型的动物组织那个表。获得的总RNA完整性好,得率高,无DNA 残留。


| 保存条件 | 运输条件 |
|---|---|
| DNase I, 10×Reaction Buffer -20℃,others RT (15-30℃) | DNase I及10xReaction Buffer -20℃保存,其他组分室温(15-30℃) |

适用于动物组织样本,如肝脏、脾脏、肾脏等。建议样本量在15–25 mg之间,某些组织不宜超过20 mg。
1) 使用无RNase的塑料制品和枪头,避免交叉污染。
2) 玻璃器皿应在使用前于180℃高温下干烤4小时,塑料器皿可在0.5 M NaOH中浸泡10分钟,用水彻底冲洗后高压灭菌。
3) 配制溶液应使用无RNase的水。
4) 操作人员戴一次性口罩和手套,实验过程中要勤换手套。
支持,该试剂盒可与CWE960 96通道核酸提取仪进行匹配使用。
可能原因:
1) 组织量过多(尤其高DNA/RNA含量的组织);
2) 匀浆不彻底;
3) DNase I 处理不充分。
DNA产量低通常由以下原因导致,请根据实际情况优化操作:
1) 试剂保存不当或使用有误。 Buffer RW2 (concentrate)首次使用前须按试剂瓶标签说明加入相应体积的无水乙醇;所有缓冲液使用后应立即盖紧,防止挥发或污染;Magbeads PN磁珠在使用前务必充分涡旋使其混合均匀。
2) 样本处理或本身存在问题。 组织取样量严格控制在15-25mg(富RNA组织如肝、脾、肾不超过20mg);使用新鲜样本或液氮速冻后-80℃保存的样本,避免反复冻融;组织研磨或匀浆必须充分彻底;裂解液Buffer PL1需在组织未完全解冻前加入,防止RNA降解。
3) 关键操作步骤执行存在偏差。加入Buffer PL2、异丙醇和Magbeads PN后,需确保充分混匀6分钟,使RNA完全结合;洗涤时小心操作,避免吸弃上清时带走磁珠;乙醇洗涤后磁珠需室温晾干3分钟以去除残留乙醇,但避免过度干燥;洗脱时使用50-70μL RNase-Free Water,65℃孵育6分钟以提高洗脱效率。
DNA在下游应用中表现不佳通常由以下原因导致:
1) 洗脱液中DNA含量极低。解决办法:请参考前文A5部分的解决方案。
2) 洗脱液中存在磁珠残留。解决办法:微量磁珠残留通常不影响实验结果。如需进一步去除,可将含有洗脱液的离心管置于磁力架上吸附后,小心转移上清至新管。
3) 存在盐离子残留。解决办法:严格按说明书操作顺序加入漂洗缓冲液。
4) DNA用量过多影响下游实验。解决办法:过量DNA可能抑制酶反应,建议使用分光光度计在260 nm处测定DNA浓度,精确控制使用量
RNA纯度低通常由以下原因导致,请根据实际情况优化操作:
1) 样本残留或降解。 样本本身含有过多蛋白质、脂肪或多糖等杂质;或样本处理不当导致RNA降解,都会影响纯度。应确保使用新鲜或妥善保存的样本,并彻底完成匀浆和裂解步骤。
2) 污染物残留。 Buffer RW1或RW2洗涤不彻底,特别是乙醇(Buffer RW2组分)残留会显著影响A260/A230比值。请确保按照说明进行充分的洗涤,并在最后一步晾干步骤中让乙醇完全挥发(室温晾干3分钟)。
3) 仪器或测量误差。 使用RNase-Free Water作为空白对照进行校准;对于高浓度RNA样本,建议进行适当稀释后重新测量。
取52 μL RNase-Free Water向其中加入8 μL 10×Reaction Buffer和20 μL DNase I(1U/ μL),混匀,配置成终体积为80 μL的反应液,配置好后放在冰上储存。









