
RNApure Fast Plant Kit
植物RNA快速提取试剂盒
¥558.00
CW0598S
- + [ 现货 ]
加入购物车
- 产品介绍
- 相关产品
- 产品参数
- 产品说明书
- FAQs

推荐样本全能型升级款产品,CW2598S,含DNase,DNA去除更彻底
本产品可从多种植物组织中快速提取总RNA,提取过程无需使用氯仿、β-巯基乙醇和DTT等有毒试剂,操作简便,提取迅速,最快只需10 min即可完成。试剂盒含有两种裂解液,分别适用于简单植物组织(如水稻、小麦、玉米、烟草、拟南芥、油菜等)、水果果肉(如草莓、枇杷、西红柿、香蕉等)、真菌(如香菇、平菇、金针菇等)、富含多糖多酚植物组织(如松针、银杏叶、小麦种子、土豆、红薯、大豆种子等)的RNA提取。提取的总RNA纯度高,无基因组DNA、蛋白质和其它杂质的污染,可用于RT-PCR、RT-qPCR、Northern Blot、Dot Blot和体外翻译等多种下游实验。
▪ 安全无毒:无需使用酚氯仿、β-巯基乙醇和DTT等有毒试剂。
▪ 兼容性广:可从多种普通植物和多糖多酚植物的茎、叶、花、果实等组织样本中提取高质量RNA。
▪ 操作简便:提取迅速,最快10min即可完成。
▪ 基因组DNA残留少:采用独特的清除技术,无需DNase I消化,有效去除gDNA污染。
1. 样本兼容性强
【实验一】使用康为世纪CW0598S提取普通植物、多糖多酚植物、水果果肉、真菌等样本的RNA,进行琼脂糖凝胶电泳分析,结果如下:
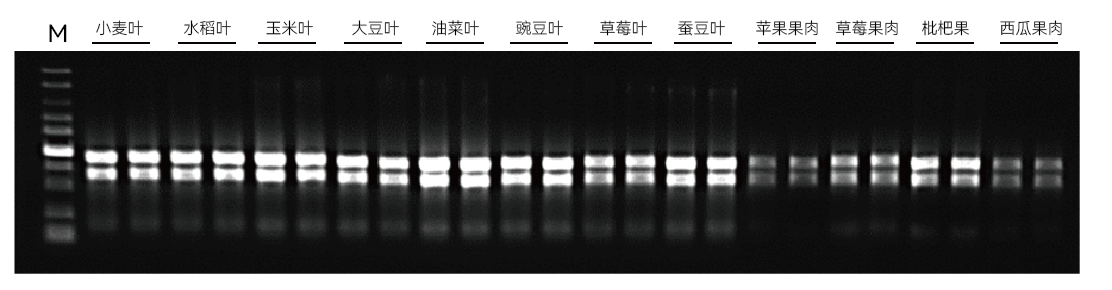
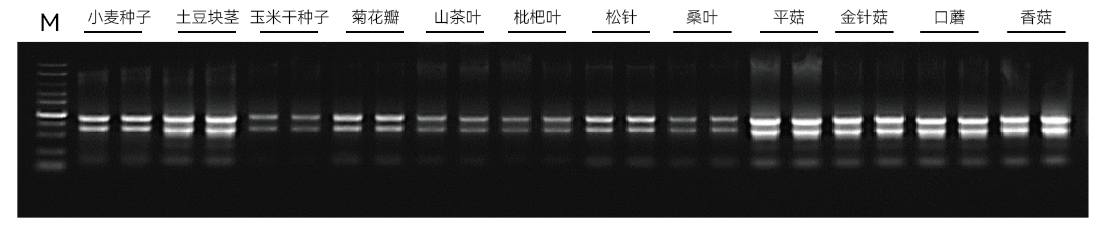
实验结果表明:康为世纪植物快速提取试剂盒可兼容普通植物、多糖多酚植物、水果果肉、真菌样本的提取,获得的RNA产量高,完整性好。
2. 得率高,完整性好
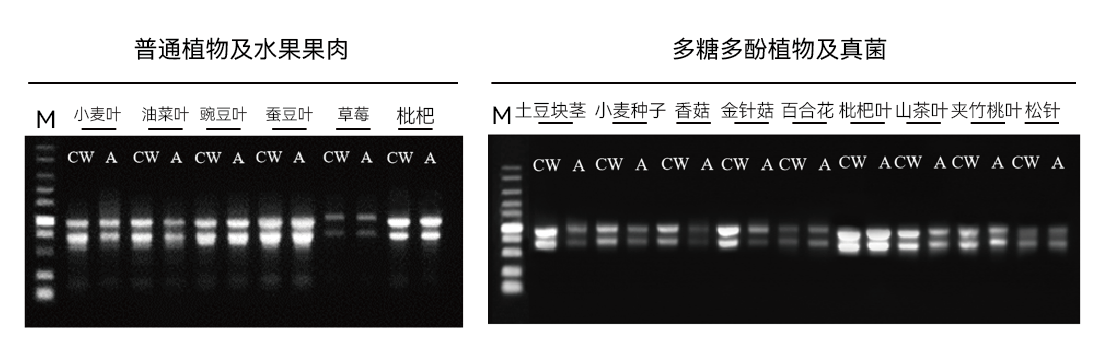
【实验二】使用康为世纪CW0598S与品牌A公司同类产品同时提取样本的总RNA,进行琼脂糖凝胶电泳分析,结果如下:


| 保存条件 | 运输条件 |
|---|---|
| RT(15-30℃) | 室温 |

1) 使用无RNase的塑料制品和枪头,避免交叉污染。
2) 玻璃器皿应在使用前于180℃高温下干烤4小时,塑料器皿可在0.5 M NaOH中浸泡10分钟,用水彻底冲洗后高压灭菌。
3) 配制溶液应使用无RNase的水。
正常。加入Buffer PA后,可能会出现沉淀物或絮状物,不影响后续实验。
本试剂盒可除去大部分DNA污染,无需DNase I消化即可用于下游实验,但不同的样本或样本的不同投入量核酸含量差异较大,若下游实验对RNA纯度要求比较严格,可选择性的进行DNase I消化,DNase I(CW2090S)需自行购买。
1) Buffer ESL:适用于普通植物(如小麦、拟南芥、油菜、豌豆的幼嫩叶片、根茎)及水果果肉(如草莓、苹果、西红柿、香蕉)。
2) Buffer RSL:适用于富含多糖多酚的植物组织(如松针、银杏叶、大豆种子、土豆、红薯)及真菌。
3) 若不明确样本类型,推荐优先尝试 Buffer RSL。
1) 淀粉含量高的植物组织(如土豆块茎、红薯块茎等)会与裂解液反应产生胶状物质,且裂解时间越长,胶状物质越多,因此样本裂解后应尽快离心取上清加入到gDNA-Filter Columns with Collection Tubes中;取上清时需避免吸取到胶状物质,以免造成gDNA- Filter Columns with Collection Tubes堵塞。
2) 若裂解液过于粘稠,可补加 600 μL 裂解液(Buffer RSL/ESL)和 10 μL Proteinase K,并涡旋混匀,下次提取时减少样本量(30–50 mg)
1) 样本未充分研磨或裂解不完全;
2) 裂解液选择不当;
3) Buffer RW2使用前未按试剂瓶标签的说明加入对应量的无水乙醇;
4) Buffer PA 加入比例不合适(水果样本建议加0.5倍体积);
5) 洗脱液体积过小(建议不少于30 μL);
6) 乙醇残留未彻底晾干。
1) 可用 65℃预热的RNase-Free Water 进行洗脱;
2) 将第一次洗脱液重新加回吸附柱中再次离心洗脱;
3) 适当增加样本量(但需避免超出推荐范围)。
1) 蛋白污染(A260/A280偏低):裂解不充分或酚类物质残留可能导致蛋白污染。确保组织在液氮中充分研磨;裂解后充分离心取上清;根据样本类型选择合适的裂解液。
2) 有机溶剂或盐残留(A260/A230偏低):漂洗步骤不彻底或乙醇残留可能导致杂质残留。严格按说明使用Buffer RW2(首次使用前需加入无水乙醇);最后空离后可开盖晾干吸附柱,确保乙醇完全挥发。
3) 操作或耗材问题:操作中引入污染物。全程使用无RNase枪头、离心管;避免频繁开启试剂瓶。
 400-0688-426
400-0688-426 
 分子原料酶
分子原料酶 
 样本采集与保存
样本采集与保存  核酸提取
核酸提取  高通量建库测序
高通量建库测序  蛋白与细胞
蛋白与细胞  耗材与仪器
耗材与仪器  单分子纳米孔测序
单分子纳米孔测序  基因合成
基因合成  引物探针合成
引物探针合成  体外诊断
体外诊断  健康服务
健康服务  医学检验
医学检验 




