
EndoFree Plasmid Midi Kit
无内毒素质粒中提试剂盒
2026.03.09-2026.03.31线上购买CW2105S 赠送5倍积分
¥298.00
CW2105S
- + [ 现货 ]
加入购物车
- 产品介绍
- 相关产品
- 产品参数
- 产品说明书
- FAQs
- 相关文献

本产品采用独特的硅基质膜吸附技术,在碱裂解法裂解细胞的基础上,高效专一的结合质粒DNA。每次可处理5-15 mL菌液,获得多至100 μg转染级质粒DNA。使用特殊的去内毒素buffer ER,有效的去除内毒素、蛋白质等杂质。产品内另配备特殊指示剂CWBlue,保障质粒提取高效完成。

▪ 操作准确:加入颜色指示剂,保证操作的准确性,得到纯度高、质量稳定的质粒。
▪ 提取得率高:适用于5-15mL菌液,质粒得率可多至100μg,提高实验效率。
▪ 无内毒素:采用特殊的缓冲液系统和去内毒素Buffer,可获得转染级质粒。
▪ 适用范围广:适用于各种大小和高低拷贝数的目的质粒。

1. 适用于高拷贝/低拷贝质粒提取
【实验一】使用康为世纪无内毒素质粒中提试剂盒(CW2105)分别取7.5mL/15mL菌液提取高拷贝(p13)及低拷贝(PEGX)质粒,结果如下:
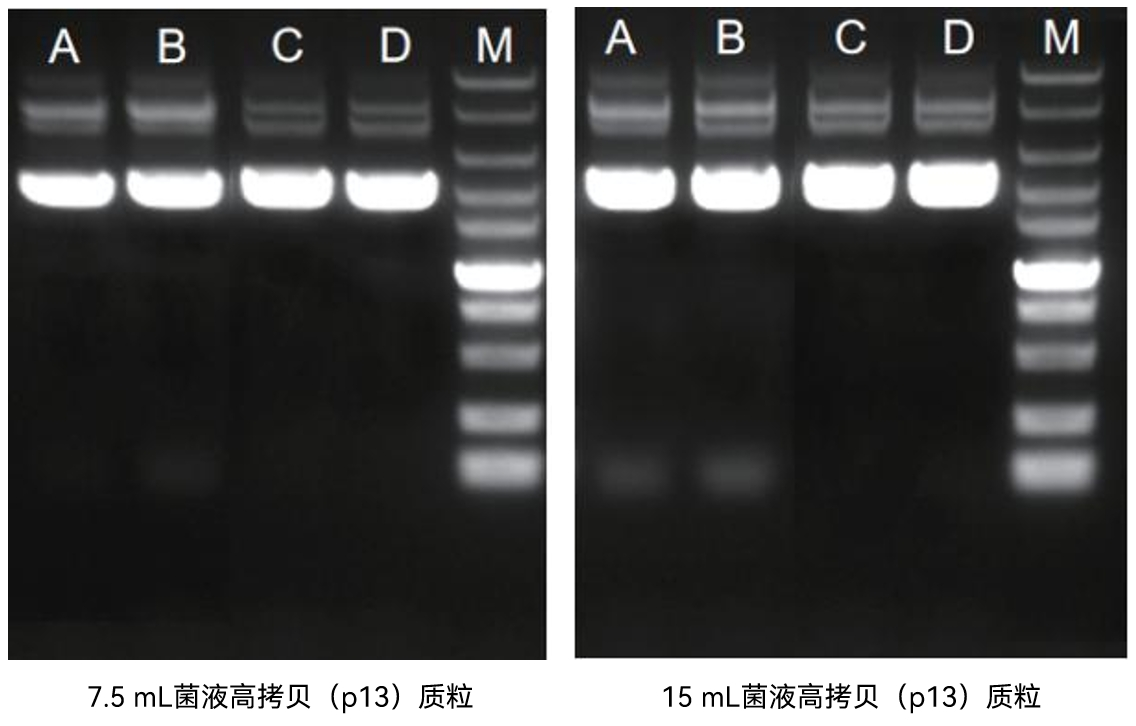
图1: M: DM10000 LaneA、B: A品牌质粒中提试剂盒 ; LaneC、D: 康为世纪无内毒素质粒中提试剂盒(CW2105)
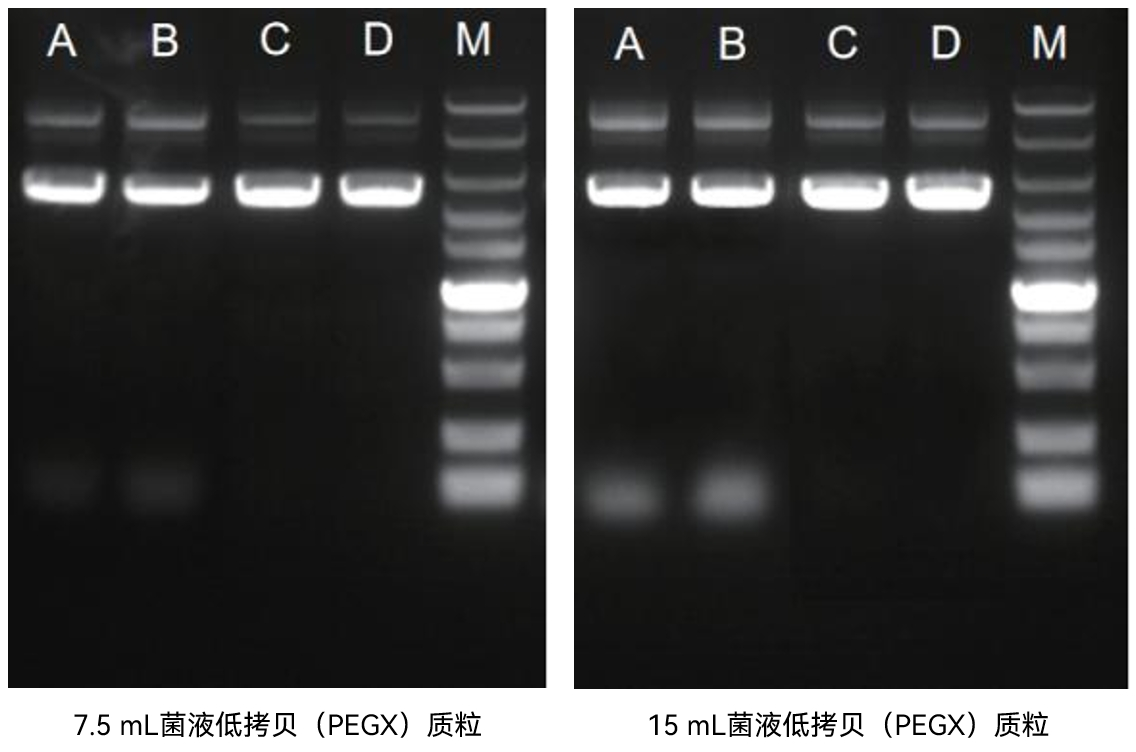
图2:M: DM10000 LaneA、B: A品牌质粒中提试剂盒 ; LaneC、D: 康为世纪无内毒素质粒中提试剂盒(CW2105)
实验结果表明:康为世纪无内毒素质粒中提试剂盒(CW2105)应用范围广,适用于高拷贝/低拷贝质粒提取,得到的质粒纯度高,完整性好。


| 保存条件 | 运输条件 |
|---|---|
| RT(15-30℃) | 常温 |

CW2105S的Buffer EB中不含有EDTA,对下游实验无影响。
可以的,但需注意仪器适配性。
若所提质粒拷贝数较低或大于10 kb的大质粒,可加大菌体使用量,同时按照比例增加Buffer P1、Buffer P2、Buffer E3的用量保证菌体可以被完全裂解,洗脱缓冲液Endo-Free Buffer EB应在65℃-70 ℃水浴锅预热,同时在吸附和洗脱时可以适当地延长时间,以增加提取效率。
(1)质粒拷贝数:载体因拷贝数差异会造成质粒产量明显的波动。高拷贝数的载体常有2-3倍的产量波动,(每毫升培养过夜的菌液,高拷贝数的质粒载体产量为3-16 μg)。长片段质粒和表达型载体常以中低拷贝数为主,每毫升菌液的产量约为0.5~2 μg;
◇低拷贝质粒:pBR322, pACYC 及其衍生载体,pSC101 及其衍生载体,SuperCos, pWE15;
◇高拷贝质粒:pTZ, pUC, pBS, pGM-T;
(2)菌种问题:菌种保存过程中存在质粒丢失现象,培养细菌前最好先划线活化,以稳定产量;
(3) 细菌未充分裂解:细菌须在Buffer P1/RNase A 中充分重悬,成团的细菌因无法裂解会降低产量;
(4) 试剂准备有误:Buffer P2和Buffer E3有沉淀析出,需37℃水浴几分钟至清亮方可使用(请勿剧烈晃动Buffer P2);Buffer PW加入乙醇体积不准确(使用前应按照试剂瓶标签的说明在Buffer PW中加入无水乙醇);
(5)将Endo-Free Buffer EB预热至65℃-70 ℃,并重复二次洗脱;
(6)培养时间过长或在 2-8℃保存时间过长会明显降低产量,建议使用新鲜的菌液。
37℃水浴混匀至澄清后使用,请勿剧烈晃动Buffer P2。
加入Buffer P2后应温和混匀,不要剧烈震荡,以免打断基因组DNA。此
步骤所用时间应不超过5分钟,避免质粒受到破坏。
导致RNA污染,需补加RNase A至Buffer P1(终浓度200 μg/mL),混匀后2-8℃保存。
乙醇残留。Buffer PW 洗涤后应尽量离心去除残留的液体,待硅胶膜完全干燥后再加入洗脱缓冲液。
不可以,因为酵母是真菌,细胞壁比大肠杆菌(细菌)的更厚,因此使用CW2105S更难裂解,建议使用Yeast Plasmid Mini Kit(CW0509S )提取。
可以。最好按照标准存放。
(1)储存温度不当或超出有效期:已加入RNase A的Buffer P1长时间室温放置可能会出现酶活下降,使用后应及时放回2 ~ 8℃。
(2)菌液体积过高:由于菌体数量过多,导致Buffer P1中RNase A不足以消化菌体中的RNA,建议减少菌液体积进行实验。
可以,该试剂盒提取的质粒纯度满足测序、PCR、酶切和转染等需求。
可以使用无菌无内毒素的核酸酶游离水(pH 7.0-8.5)从离心柱中洗脱DNA,以获得最佳洗脱效率。如需长期保存DNA,推荐使用试剂盒配套的DNA洗脱缓冲液。
在质粒条带上方出现的拖尾现象可能表明质粒提取物中存在基因组DNA污染。虽然这种情况并不常见,但基因组DNA可能在裂解过程中被剪切并与质粒共同纯化。加入Buffer P2后剧烈摇晃或涡旋可能会产生断裂的基因组DNA,应避免这种情况。如果裂解液非常粘稠且混合不均匀,建议减少实验使用的细胞起始量。
A260/280比值通过比较核酸最大吸收峰260nm与蛋白质最大吸收峰280nm的吸光度值,可评估所洗脱DNA的相对纯度。若中和反应不充分或洗涤步骤不完全,可能导致过量蛋白质残留在基质中并与DNA共同洗脱。
培养基成分和某些细胞成分会降低A260/A230比值。按照实验方案操作可确保去除这些污染物。此外,某些颗粒物可能与DNA一起洗脱,从而影响该比值。若出现这种情况,可在分光光度计(如Nanodrop®)检测前对洗脱的DNA进行额外15秒离心以沉淀颗粒物。
培养基成分和某些细胞成分会降低A260/A230比值。按照实验方案操作可确保去除这些污染物。此外,某些颗粒物可能与DNA一起洗脱,从而影响该比值。若出现这种情况,可在分光光度计(如Nanodrop®)检测前对洗脱的DNA进行额外15秒离心以沉淀颗粒物。
虽然Endo-Remover FM和Buffer ER能去除样品中绝大部分内毒素,但无法保证回收的DNA完全不含内毒素。需要说明的是,我们已成功使用该试剂盒回收的质粒DNA转染多种耐受性强的细胞系。尽管其他供应商可能宣称其小提试剂盒"无内毒素",但通常仍可检测到微量内毒素存在。
为确保实验材料无内毒素污染,建议遵循以下操作规范:首选经认证的无热原/内毒素一次性塑料耗材(市售多种品牌可选),避免使用玻璃器皿—因其表面易吸附内毒素且常规清洗和高压灭菌均无法有效清除(若必须使用玻璃器皿,需180℃干热过夜处理)。特别注意曾接触细菌的灭菌锅会造成玻璃器皿二次污染。
可进行内毒素去除加强版的操作步骤。若Buffer ER出现沉淀,请于37℃加热至完全溶解并充分混匀后使用。加入ER缓冲液后需上下颠倒以确保充分混匀。
柱平衡是通过Buffer PS预处理吸附柱,目的是激活硅基质膜,提高其对质粒DNA的结合效率,从而提升最终产物的纯度和得率。
非必需,但建议添加以便监控裂解(变蓝色)和中和(无色+白色沉淀)效果。

 400-0688-426
400-0688-426 
 分子原料酶
分子原料酶 
 样本采集与保存
样本采集与保存  核酸提取
核酸提取  高通量建库测序
高通量建库测序  蛋白与细胞
蛋白与细胞  耗材与仪器
耗材与仪器  单分子纳米孔测序
单分子纳米孔测序  基因合成
基因合成  引物探针合成
引物探针合成  体外诊断
体外诊断  健康服务
健康服务  医学检验
医学检验 





